接續上篇 http://swospam0418.pixnet.net/blog/post/459535084,
繼續從化學實驗室常使用的乾燥劑的角度,討論中興化工這次意外的可能原因。
除水步驟是化學合成實驗室最普遍、基本的步驟之一,
原因是許多化學反應都對水份在反應系統中的量有很嚴格的要求,
比方說與「異氰酸酯」isocyanate有關的反應,由於異氰酸酯和水有很強的反應性,因此會干擾正常反應的進行,
所以在進行與異氰酸酯有關的反應時,所有的反應物與溶劑都要妥善除水。
我在柏克萊大學參與的實驗室,是直接向藥品商購買不含水的反應溶劑,
使用時要先以氮氣充滿器皿使其呈現正壓,再用針頭小心地取出溶劑。
實驗室一位來自歐洲的博士後甚至誇口說:
I am not paid to dry solvent in the lab. 也就是「我的薪水不是讓我待在實驗室裡幫溶劑除水的。」 (太任性了lol…)
然而,無水溶劑的價格往往比未除水的同一商品還要貴上許多,以台灣的實驗室的經費狀況,無法負擔這樣子的花費,
因此在一般的專業化學實驗室中,為了讓溶劑的含水量能達到極低,
往往會善用從國中 (嗯沒錯,就是國中)開始累積的物理化學知識,讓溶劑可用於反應。
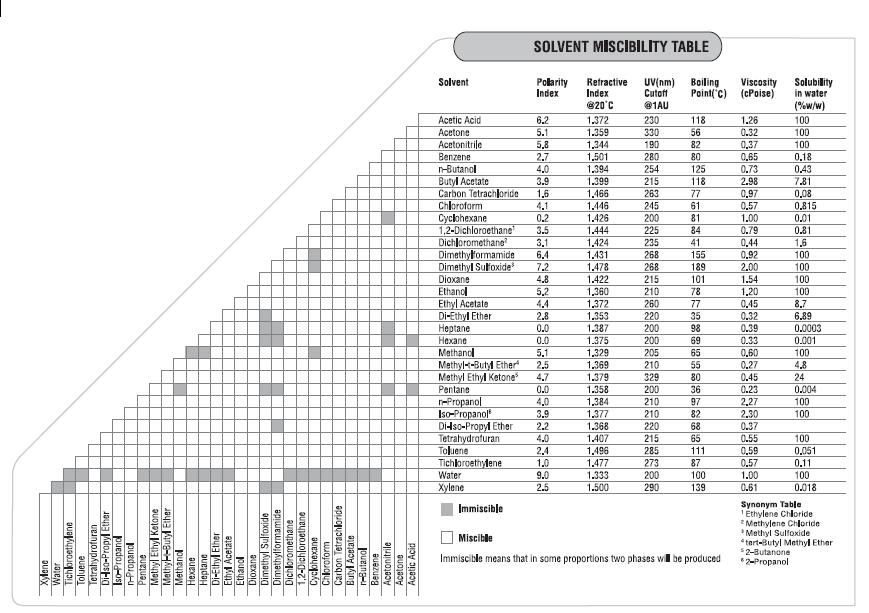
上面所示的表格是非常著名 (全世界都在用)的「溶劑互容表格」(miscibility table)
透過這個表格可以方便我們制定替溶劑除水的策略。
比方說以「二甲苯」 (xylene)而言,其做為芳香型溶劑,與水的相容性非常低,加上含水量高的xylene具有密度較高的特性,
因此透過蒸餾法反覆蒸餾,再取出最底層的一部分餾液,就能取得除水xylene。

但是我們可以注意到還是有不少有機溶劑與水有很高的相容性,
例如二甲基亞碸 (DMSO)、二甲基二醯胺 (DMF)、四氫呋喃 (THF)等等,
另外即便是不會與水相容的有機溶劑如甲苯 (toluene),但還是多少存在上百ppm的水份,
如果化學反應需要很嚴苛的無水環境,顯然這還是不夠的,
因此要有比物理方法和硫酸鎂生成含水化合物等還要更激烈的方法,就是利用化學反應把水給反應掉 !
第一個要介紹的乾燥劑即氫化鈣 Calcium Hydride,一般為略帶灰色的粉末,

其與水會快速作用,形成氫氧化鈣 calcium hydroxide (即熟石灰)與氫氣,反應式如下:

為了避免危險,平常是被存放在濕度精準控制的乾燥箱中,並以parafilm緊纏封口。
使用時只要把粉末加進溶劑中,攪拌約2~3天後,就能將溶劑以蒸餾法取出,
前面提到的DMF和DMSO基本上都是用calcium hydride除水,記得在攪拌時要用針頭在血清塞 (stopper) 上戳一個洞,
方便氫氣漏出,要不然如果容器承受的壓力太大,會有爆炸的風險。
一些網路影片聲稱乾燥劑碰到水會爆炸,事實上主要原因應該是沸騰的水蒸氣與氫氣導致容氣內部壓力過大而爆炸,
當然,氫氣與水蒸氣的共存導致爆炸也是因素之一,
另外,在蒸餾過程中要取出除水溶液時,要用氮氣給予容器正壓,以徹底防止空氣中的水氣進入。
筆者自身曾有不當的使用經驗,當時是大掃除,我正在清理實驗室前人遺留的圓底瓶 (flask),一時沒注意裡面有氫化鈣,
便直接以自來水灌入,
結果自來水迅速與氫化鈣反應後沸騰,圓底瓶的內含物全部都瞬間噴發,
幸好當時筆者把瓶口面對水龍頭,不然會噴滿我全身,更不用說存在著氫氣被引燃的可能性了 (雖然不高)
這真的是千鈞一髮的時刻,因此在實驗室內務必隨時穿戴好護具。
與氫化鈣類似的乾燥劑,還包括硫酸鈣 calcium sulfate,也就是生石灰,
是相當常用的食品用乾燥劑,和水反應後一樣是生成氫氧化鈣,
因此就有如我於上篇所說,千萬別讓小孩接觸到乾燥劑,因為真的不是鬧著玩的,
不只是高溫而已,強鹼物質也會對孩子的皮膚與肌肉組織受到傷害。
接下來要介紹另一個常用的乾燥劑,這大概是化學實驗室中最危險的時刻之一。
這個乾燥劑就是國中生也耳熟能詳的金屬: 金屬鈉 (Sodium)
先來段影片:
金屬鈉與水的反應非常快速與劇烈,因此很適合用在難以除水的溶劑如甲苯 Toluene
(各位可以試想,這種溶劑本身含水量就極少了,所以要抽取這些水出來也相形困難了)
由於效果很好,因此我們還是會視其必要性而利用之,不過當然是能免則免。
反應式如下:

由於金屬鈉十分危險,因此平常是存放在矽油中。

使用前,為了增進反應速率且避免浪費材料,會利用剪刀剪下一小塊鈉 (鈉很軟)後,
把它擀成扁扁的長條狀物,再丟入溶劑中。
鈉相對於氫化鈣,除了有反應速率更快、除水更有效的優點以外,還有易於分辨含水量是否已達到標準的優點。
原因是利用鈉會與二苯基甲酮 (benzophenone) 反應生成深藍色ketyl自由基的特點,
當水存在於系統中時,會去質子化自由基生成無色的產物,因此系統會呈現相當澄澈的藍色,
而隨著水逐漸被鈉給反應,系統的顏色會不斷加深到成為深藍色。
在加入鈉條並開始蒸餾流程 (要讓系統一直迴流)後,待一部分水已和鈉條反應後,
再加入少量benzophenone,觀察顏色變化,等顏色已深得差不多了,就可以開始收集餾液。

如果不再需要反應系統,要將東西都處理掉時,要如何避免鈉條發生危險呢?
答案是要利用與金屬鈉反應不會那麼劇烈的溶劑,終止 (quench)其反應性。
把用畢的鈉條小心撿起後,放入大量常用的有機質子性溶劑如異丙醇 (isopropyl alcohol)或是新丁醇 (tert-butanol)中,
因為反應較不劇烈,因此比甲醇 (methanol)更理想。
在quench的過程中可注意到系統不斷冒泡,等數小時過後,大概不再冒泡了,再將金屬鈉倒進大量的水裡,確認反應性已去除,
再丟棄之。
在使用金屬鈉時,務必要抱持「戒慎恐懼」的心情,提高注意力,
這次的危險事件並非發生在我自身,而是在我同學身上。
當時他並沒有完全quench掉鈉的反應性,結果就轟然起火,洗手台的凹槽整個燒了起來,
當時我們措手不及,只能任由火燒完,幸好當時周遭沒有其它易燃物。
正確的處理方法,應是使用消防砂,或是能用於金屬火災的滅火器,千萬不能用一般的滅火器,
原因是大量猛然生成的二氧化碳反而會讓著火的材料四散,導致更難以收拾。
以上就是我想討論的利用化學反應為機制的乾燥劑,
當然不只這兩種,
像針對甲醇與乙醇的話,則會以氫氧化鉀 KOH 除水,
但是一方面甲醇和乙醇通常用量不大,另一方面我過去的實驗室也都是直接買無水產品,
因此就不拿來討論了。
除了化學機制的乾燥劑以外,物理機制的乾燥劑如分子篩也是很常見的乾燥劑,
利用表面的多孔洞結構,使水分子吸附於孔洞中,
而且這類乾燥劑擁有加熱除水後再重新高溫活化就能回收再利用的優點。
回到原本的主題,
既然我不認為硫酸鎂是造成這次中興化工起火的兇手,那還有可能是什麼呢?
我想答案就是氫化鈣或是鈉條中二選一了吧,
因為只有他們才足夠常見,而且反應也劇烈到足以造成爆炸與燒燙傷。
至於到底是哪一個,有點難說,因為我們對於現場的情狀完全不清楚。
我寧可相信該生誤丟的是氫化鈣,畢竟我相信在實驗室中使用氫化鈣卻沒想過背後機制的人應該還不少,
而如果誤丟的是金屬鈉,那該生恐怕得花點時間找回自己的基本科學素養了。
參考資料與文獻:
https://pdfs.semanticscholar.org/ec7d/d3c01b54535f93d48187980c11e0f789f47f.pdf
https://www.scripps.edu/shenvi/Education_files/Drying%20Solvents%20handout.pdf




 留言列表
留言列表

